在化學研究和工業生產中,特定氣體的制備、凈化與收集是基礎且至關重要的操作。這三個環節環環相扣,共同決定了最終獲得氣體的純度、產量與安全性。它們不僅是化學原理的直觀體現,也是實驗技能的綜合應用。
一、氣體的制備:原理為先,方法為徑
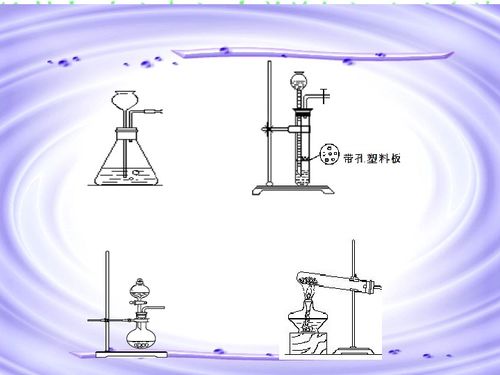
氣體的制備主要依據特定的化學反應。根據反應物的狀態(固態、液態)及反應條件(加熱與否),實驗室常用以下三種裝置:
- 固體加熱型:適用于反應物均為固體且需加熱的反應,如實驗室用氯酸鉀與二氧化錳混合加熱制取氧氣。裝置通常由鐵架臺、酒精燈和硬質試管組成。
- 固液不加熱型:適用于塊狀固體與液體在常溫下的反應,如用鋅粒與稀硫酸反應制取氫氣,或用石灰石(大理石)與稀鹽酸反應制取二氧化碳。常用啟普發生器或其簡易裝置,能隨時控制反應的發生與停止。
- 固液或液液加熱型:適用于反應物需在加熱條件下進行的反應,如用氯化銨與氫氧化鈣固體混合加熱制取氨氣。此時需用到圓底燒瓶、分液漏斗和熱源。
選擇何種制備方法,核心在于對目標氣體化學性質的深刻理解及對反應速率、安全性和便利性的綜合考慮。
二、氣體的凈化:去蕪存菁,提純是關鍵
從反應裝置中導出的氣體往往混有水蒸氣、酸霧或其他副反應氣體雜質,必須經過凈化處理。凈化的原則是:不損失主體氣體、不引入新雜質、操作安全簡便。
- 除雜試劑的選擇:需根據雜質與目標氣體的性質差異。例如,可用濃硫酸干燥酸性或中性氣體(如CO?、Cl?),但不能干燥堿性氣體(如NH?);堿性干燥劑(如堿石灰)則用于干燥堿性氣體。若混有酸性雜質(如HCl),可用堿性溶液(如NaOH溶液)洗氣,但需確保目標氣體不被吸收(如CO?會被NaOH吸收,故不可用)。
- 裝置順序:通常先除其他化學雜質,最后干燥除去水蒸氣。洗氣瓶(長管進氣,短管出氣)是常用裝置。
三、氣體的收集:因“氣”制宜,方法各異
收集方法完全取決于氣體的物理性質(密度、溶解性)和化學性質(是否與空氣或水反應)。
- 排水法:適用于不易溶于水且不與水反應的氣體,如H?、O?、CO。此法收集的氣體純度較高。
- 向上排空氣法:適用于密度比空氣大(相對分子質量>29)且不與空氣成分反應的氣體,如CO?、Cl?、SO?。集氣瓶口向上,導管伸入瓶底。
- 向下排空氣法:適用于密度比空氣小(相對分子質量<29)且不與空氣成分反應的氣體,如H?、NH?。集氣瓶口向下,導管伸入瓶底。
對于有毒或有害氣體,必須在密閉系統或通風櫥中進行,并對尾氣進行適當處理(如吸收),防止污染。
###
氣體的制備、凈化與收集是一個系統性的工程。從反應原理的設計,到中間雜質的去除,再到最終產品的獲取,每一步都蘊含著豐富的化學知識。掌握這些核心環節,不僅能保障實驗的順利進行與人身安全,更是理解物質轉化、探索化學世界的重要基石。在實際操作中,必須嚴謹規劃流程,靈活運用知識,才能高效、安全地獲得所需氣體。